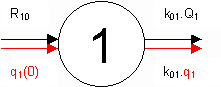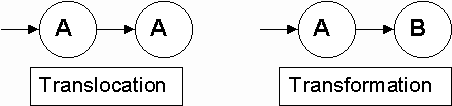Introduction générale II. Principes de base de la Pharmacocinétique
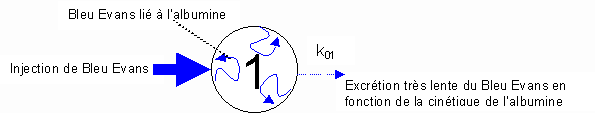
Pour une substance donnée, médicament, marqueur radioactif ou autre molécule, qui évolue dans l’organisme, l’ensemble organisme-substance constitue un système particulier régi par des lois plus ou moins bien connues et influencé par de multiples facteurs internes et externes au système. Dans un tel système la substance étudiée subit des transferts d’une entité anatomique ou structurelle à une autre entité, entités que l’on appelle compartiments. Le "compartiment" est défini comme un "ensemble de molécules qui ont statistiquement le même devenir cinétique" (Simon, 1964). A un moment donné il n’est pas possible de prévoir quelle molécule du compartiment sera transférée à un autre. Il peut arriver que le compartiment soit superposable à un volume anatomique. Par exemple le Bleu Evans qui reste confiné au liquide plasmatique vasculaire parce qu’il est fortement lié aux albumines circulantes est restreint à un compartiment identique au volume plasmatique (Fig. 4). |
||||
|
Figure 4 : Schéma du comportement du Bleu Evans après injection dans le compartiment plasmatique.
|
||||
| Le cercle de la figure 4
représente le compartiment occupé par le Bleu Evans défini par son volume V1 (exprimé
en unité de volume équivalent de plasma). Ici V1 est le volume de
répartition du Bleu Evans, identique au volume de plasma sanguin, tel que V1
= Dose injectée / concentration plasmatique. La constante k01 est la constante
d’élimination du Bleu Evans. Les transferts d’un compartiment à l’autre s’effectuent selon la loi de Fick bien connue des étudiants en physiologie, [f1->2=C1*V1*k21], telle que le flux de sortie f1->2 du compartiment est toujours proportionnel à la quantité de substance dans le compartiment de départ (compartiment 1), indépendamment de la quantité de la même substance dans le compartiment d’arrivée (compartiment 2). Un système dynamique est constitué d’un ou plusieurs compartiments reliés entre eux par des processus de transferts assimilables au principe de Fick évoqué plus haut. (Voir animation pour un système à 2 compartiments en état stationnaire). Si on considère à titre d’exemple l’eau contenue dans l’organisme elle est grossièrement répartie dans trois compartiments que sont le plasma sanguin, le liquide interstitiel et le liquide intracellulaire, séparés par des barrières biologiques (paroi des vaisseaux sanguins, membranes cytoplasmiques, ...). Chacun d'eux est défini par son volume équivalent de plasma V1 à 3, sa masse en eau Q1 à 3 et son taux de renouvellement mesuré par le flux d’entrée ou le flux de sortie si le système est en état stationnaire (c. à d. que la somme des entrées est égale à la somme des sorties) |
||||
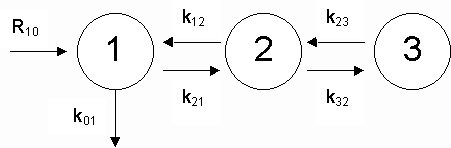
Figure 5 : Modèle théorique du métabolisme de l’eau corporelle. |
||||
|
||||
| La figure 5 représente le modèle théorique du métabolisme de l’eau où le mot métabolisme désigne l’ensemble des événements subis par l’eau dans l’organisme. Les indices utilisés ont été recommandés par une commission internationale (Brownell et al., 1968} dans un souci d’homogénéité entre les utilisateurs : le premier chiffre indiciaire identifie le compartiment d’arrivée, le second le compartiment de départ. Ainsi la constante k21 désigne le taux de transfert du compartiment 1 au compartiment 2. Par convention 0 (simplification pour ‘outer’) désigne ce qui est extérieur au système : par exemple R10 signifie le flux d’eau de l’extérieur vers le compartiment 1. Les valeurs suivantes sont représentatives de ce que l’on sait du métabolisme moyen de l’eau chez un homme adulte en bonne santé. Elles ont été idéalisées et nous servirons de références dans les chapitres à venir : | ||||
| V1 ~ 3 litres | Q1 ~ 3 kg (eau plasmatique) [conc. C1 = Q1 / V1 ~ 1 kg / l] | |||
| V2 ~ 12 litres | Q2 ~ 12 kg (eau du liquide interstitiel) | |||
| V3 ~ 25 litres | Q3 ~ 25 kg (eau du liquide intracellulaire) | |||
| R10 ~ 0,12 kg/heure | (équivalent à 2,88 kg d'eau / jour) | |||
| k01 ~ 0,04/h tel que | Q1* k01 ~ 0,12 kg/h | |||
| k21 ~ 52/h | Q1* k21 ~ 156 kg/h (plasma) | |||
| k12 ~ 13/h | Q2* k12 ~ 156 kg/h | |||
| k32 ~ 2,75/h | Q2* k32 ~ 33 kg/h | |||
| k23 ~ 1,32/h | Q3* k23 ~ 33 kg/h | |||
| Il est évident que
suivant les individus et leurs conditions physiologiques ces paramètres prennent des
valeurs légèrement différentes. Notons au passage l’énorme quantité d’eau
échangée entre le plasma et le liquide interstitiel, voisine de 4 tonnes par jour, entre
le liquide interstitiel et le liquide intracellulaire, environ 1 tonne par jour, en
comparaison des 3 litres échangés quotidiennement entre le corps et
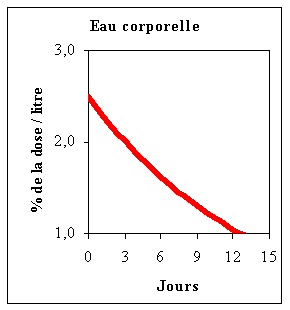
l’extérieur ! Au modèle théorique est associé un modèle mathématique qui est le réseau d’équations caractéristiques du modèle et permettant de quantifier les volumes, les masses et les flux de transfert. Nous établirons ultérieurement quelques modèles théoriques et mathématiques d’utilisation courante dont ceux associés avec le métabolisme de l’eau. Il arrive fréquemment que des modèles complexes comme celui de l’eau (Fig.5) soient réductibles à un seul compartiment si les échanges à l’intérieur du système entre les sous-compartiments sont intenses. Ainsi 2 heures environ après l’injection d’eau tritiée (3H2O) dans la circulation veineuse d’un humain adulte, la radioactivité spécifique ou RAS de l’eau (3H2O/H2O totale) est quasi identique dans tous les compartiments. Il faut environ 5 minutes pour que les compartiments 1 et 2 soient à peu près à la même RAS. Si on mesure la RAS de l’eau pendant plusieurs jours, on observe une décroissance exponentielle de la RAS de l’eau plasmatique (Fig. 6). Dans les 22-23 heures après l'injection du marqueur, la moitié de l'eau tritiée a disparu. |
||||
Figure 6 : Evolution de la concentration plasmatique en eau tritiée en fonction des jours suivant l’injection d’une dose traceuse de marqueur. |
||||
| Cette décroissance est absolument comparable à la disparition de mode aléatoire de la radioactivité d’un isotope quelconque. Il s’agit d’un système monocompartimental où le flux d’eau qui entre R10 égale le flux sortant (Fig. 7). | ||||
Figure 7 : Système à 1 compartiment de volume V1 et de masse Q1 avec flux d’entrée R10 et flux d’élimination k01x Q1. |
||||
| Un tel système est
défini par son volume V1 (= 40 litres), sa masse Q1 (= 40 kg
d’eau). Si le flux quotidien d’eau R10 qui pénètre dans le corps
est égal à 2,88 litres, le renouvellement de l’eau corporelle totale est aussi de
2,88 kg / jour. La constante d’élimination k01 qui, dans le cas d’un
système monocompartimental, est aussi la constante de renouvellement égale 7,2 % / j
(=100x2,88/40). Ce modèle simple montre la relation existant entre un traceur ou marqueur, ici l’eau tritiée, et la substance endogène ou marqué, ici l’eau corporelle. Le marqueur et le marqué participent du même compartiment car ils ont le même devenir cinétique. On peut donc établir les modèles mathématiques pour le marqueur et le marqué : |
||||
Figure 8 : Modèle à 1 compartiment où se superposent le système du marqué (symboles noirs) en état stationnaire et le système du marqueur (symboles colorés) en état non stationnaire. |
||||
| R10
correspond à une perfusion de marqué (ingestion et autres entrées d’eau) et q1(0)
représente la quantité de marqueur injecté en une seule fois (bolus) au temps t
= 0. Q1 correspond à la masse de marqué (eau) et q1 à la
quantité de marqueur (3H2O) présents dans le compartiment 1. Le
volume V1 et la constante k01 sont identiques pour le marqué et le
marqueur. A la notion importante de flux, exprimé en masse ou en moles / unité de temps, est associée la notion tout aussi importante de clairance exprimée en volume / unité de temps. Il ne s’agit pas fondamentalement d’un transfert matériel de liquide mais d’un "volume liquidien épuré de la substance par unité de temps" dont on étudie le métabolisme cinétique. Si le flux est le produit d’une constante de transfert k01 par la masse Q1 du compartiment 1 tel que R10 = k01*Q1 (ici en kg d’eau / jour), la clairance associée Cl01 ou Clp (indice p pour plasmatique) est le produit de la même constante de transfert par le volume V1 du compartiment 1 tel que Cl01 = k01*V1 (ici en litres / jour). Bien que la clairance représente un débit d’épuration, il peut arriver qu’elle corresponde à un transfert réel de liquide. C’est le cas de l’eau marquée par 3H2O, c’est aussi le cas de la clairance rénale de l’inuline qui exprime le flux de filtration glomérulaire et le débit d’épuration plasmatique de l’inuline. Pour terminer ce chapitre d’initiation, ajoutons que la notion de transfert dans un système dynamique compartimental recouvre aussi bien les déplacements de la molécule intacte d’un compartiment à un autre (transfert par "translocation") que la transformation de la molécule en un ou plusieurs métabolites (transfert par "transformation" biochimique). Ce concept est illustré par les schémas de la figure 9. |
||||
Figure 9 : Echanges par déplacement ou translocation d’une substance A entre deux compartiments géographiquement distincts, et par transformation de A en une substance B les compartiments A et B étant géographiquement confondus. |
||||
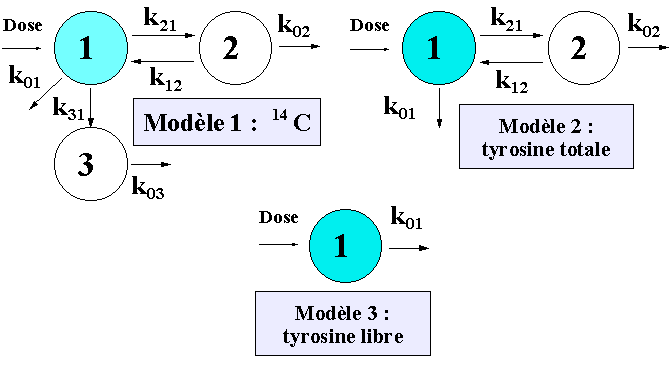
| En général un transfert par transformation correspond à une sortie du système ou élimination. Lorsqu’il s’agit d’une molécule radioactive, le système peut être conçu pour la radioactivité globale et les compartiments représenter des métabolites différents marqués par le même isotope. Pour illustrer cette notion supposons que l’on suive le devenir d’un acide aminé, la tyrosine, marqué sur le carboxyle par 14C (t½ = 5600 ans) et injecté par IV : de la tyrosine marquée circule librement, une partie est incorporée dans des protéines, après désamination et oxydation on retrouve du CO2 et du bicarbonate marqués par le 14C. Suivant que l’on considère le 14C, la tyrosine sous toutes ses formes ou la tyrosine libre les modèles utilisés seront différents (Fig. 10). | ||||
Figure 10 : Modèles théoriques concernant la tyrosine-14C suivant que l’on considère le 14C sous toutes ses formes (modèle 1), la tyrosine totale, libre et associée aux protéines, (modèle 2), la tyrosine libre seule (modèle 3). Pour plus de détails lire le texte. |
||||
| Pour les trois modèles de la figure 10 le compartiment 1 ou compartiment central dans lequel la dose de tyrosine radioactive a été injectée est le pool tyrosine libre. Le compartiment 2 représente la tyrosine marquée présente dans des protéines et le compartiment 3 les formes de dégradations de la tyrosine, en particulier sous forme de CO2 et de bicarbonate marquées par le 14C. Il est clair que d’un modèle à l’autre les constantes de transfert n’ont pas la même valeur. Par exemple la constante k01 du modèle 3 est égale à la somme des constantes k01, k21 et k31 du modèle 1, elle-même égale à la somme des constantes k01et k21 du modèle 2. Les trois démarches sont aussi rigoureuses l’une que l’autre et témoignent de la souplesse qu’offre la méthode dans le choix des moyens d’analyse d’un métabolisme. | ||||