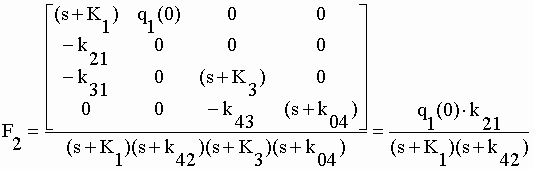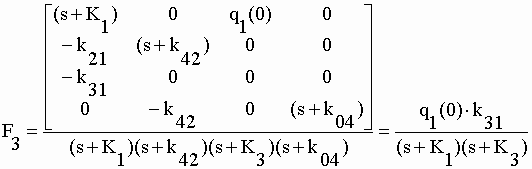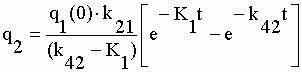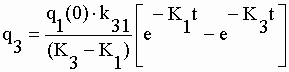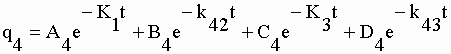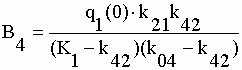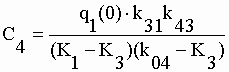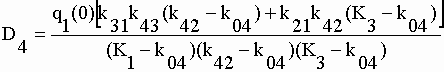Chapitre V Applications : analyse de flux métaboliques, pharmacocinétiques. |
|||||||||||||||||||||
| III. Métabolisme in vitro du Diazepam (suite et fin) | |||||||||||||||||||||
| Le modèle mathématique est le réseau des quatre équations différentielles linéaires: | |||||||||||||||||||||
| dq1/dt
= - K1 q1 dq2/dt = + k21 q1 - k42 q2 dq3/dt = + k31 q1 - K3 q3 dq4/dt = + k42 q2 + k43 q3 - k04 q4 |
V-28 | ||||||||||||||||||||
| à partir desquelles est construite l'équation matricielle générale : | |||||||||||||||||||||
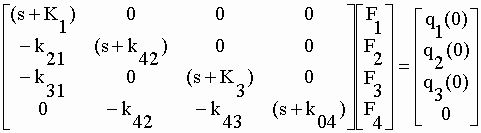 |
V-29 | ||||||||||||||||||||
| Ici, q1(0), q2(0) et q3(0) représentent respectivement la quantité de DZ de NOR ou de TEM introduite dans le milieu de culture au temps t = 0 (Fig. V-10). Lorsque l'une de ces trois valeurs est positive, les deux autres sont nulles. La matrice carrée d'ordre 4x4 présente une particularité intéressante : toutes les valeurs au-dessus de la diagonale sont nulles. Il s'agit d'une "matrice diagonale" dont le déterminant est tout simplement le produit des éléments de la diagonale, soit : | |||||||||||||||||||||
| |A| = (s+K1) (s+k42) (s+K3) (s+k04) | V-30 | ||||||||||||||||||||
| Nous nous intéresserons essentiellement aux cinétiques consécutives à l'introduction du seul DZ (Fig. V-9) lorsque q1(0) est positif et q2(0) et q3(0) sont nuls. Les transformées de Laplace Fn (n = 1, …, 4) sont obtenues comme précédemment (voir chap. I et II) en substituant la matrice scalaire résultat [[q1(0), 0, 0 ,0]] à la colonne n de la matrice numérateur. | |||||||||||||||||||||
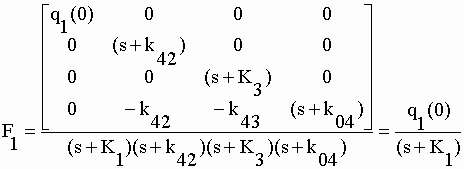
|
V-31 | ||||||||||||||||||||
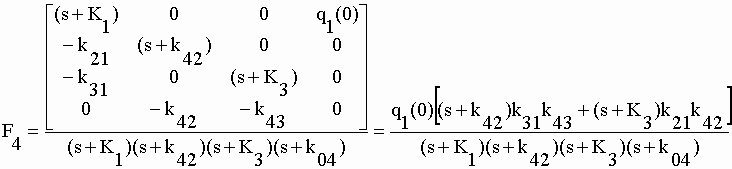 |
|||||||||||||||||||||
| Les matrices au numérateur ont d'intéressantes propriétés qui facilitent l'obtention des déterminants. Celle de F1 est une matrice diagonale dont le déterminant est égal au produit des seuls éléments de la diagonale. Dans les numérateurs de F2, F3 et F4 le cofacteur de (s+K1) est nul : comme on peut facilement le vérifier le déterminant d'une matrice carrée dont tous les éléments d'une colonne et/ou d'une ligne sont nuls est nulle. Le déterminant de ces matrices au numérateur n'est donc que le produit de q1(0) par son minorant. (voir chap. I). Des transformées on tire les fonctions : | |||||||||||||||||||||
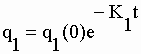
|
V-32 | ||||||||||||||||||||
| Les coefficients exponentiels de la fonction q4 sont : | |||||||||||||||||||||
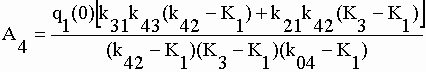
|
V-33 | ||||||||||||||||||||
| Les expressions numériques des courbes du métabolisme de DZ (Fig. V-9) sont données en nanomoles, en considérant que l'introduction de 20 µM de DZ correspond à q1(0) = 40 nanomoles : | |||||||||||||||||||||
| q1 =
40 e - 1,01 t pour DZ, q2 = - 27,615 (e - 1,01 t - e - 0,054 t ) pour NOR, q3 = - 13,571 (e - 1,01 t - e - 0,45 t ) pour TEM, q4 = 3,595 e - 1,01 t - 5,529 e - 0,45 t - 9,901 e - 0,18 t + 11,835 e - 0,054 t pour OX, |
V-34 | ||||||||||||||||||||
| à partir desquelles
sont calculées les microconstantes caractéristiques du système. Les constantes exponentielles étant aussi les constantes d'exit de chacun des compartiments (éq. V-32) on a directement K1, k42, K3 et k04. Des coefficients exponentiels de q2 et q3 on extrait respectivement k21 et k31. Avec le coefficient exponentiel C4 de q4 (éq. V-33) on obtient la constante de production d'OX à partir de TEM soit k43. Les constantes de production des métabolites non identifiés s'obtiennent par différence : k01 = K1 – (k21+k31) et k03 = K3 – k43. Toutes ces valeurs sont rassemblées dans le tableau V-5. |
|||||||||||||||||||||
Tableau V-5 : Microconstantes du métabolisme du diazepam et de ses métabolites au contact d'hépatocytes de singe en culture. |
|
||||||||||||||||||||
| Les expériences isolées avec les métabolites purs NOR et TEM (Fig. V-9) confirment ces résultats. Après introduction de q2(0) = 12 nanomoles de NOR (=6 µM) dans les cultures de cellules les courbes de concentrations en NOR et OX en fonction du temps sont exprimées par les équations : | |||||||||||||||||||||
| q2 =
12 e - 0,054 t pour NOR, q4 = 5,142 (e - 0,054 t - e - 0,18 t ) pour OX, |
V-35 | ||||||||||||||||||||
| où l'on retrouve dans l'expression de q2 la constante k42 = 0,054 / h et dans l'expression de q4 la constante k04 = 0,18 / h. Après introduction de q3(0) = 40 nanomoles de TEM (=20 µM) on a les équations des courbes de concentrations en NOR et OX : | |||||||||||||||||||||
| q3 =
40 e - 0,45 t pour TEM, q4 = - 16,296 (e - 0,45 t - e - 0,18 t ) pour OX, |
V-36 | ||||||||||||||||||||
| où l'on retrouve les
constantes K3 = 0,45 / h dans q3 et k04 = 0,18 / h dans q4.
Le calcul effectué avec le coefficient exponentiel de q4 " - 16,296 = q3(0)
k43 / (k04 - K3) " on obtient bien k43 =
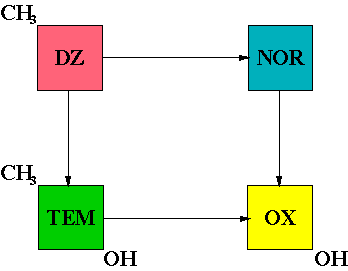
0,11 / h. La figure V-11 schématise les réactions enzymatiques, déméthylations et hydroxylations, subies par les benzodiazépines. |
|||||||||||||||||||||
Figure V-11 : Schéma de transformation du diazepam (DZ) par déméthylation (réactions horizontales) et hydroxylation (réactions verticales). |
|
||||||||||||||||||||
| L'analyse compartimentale a permis aux auteurs d'estimer la fraction de substrat métabolisée par une voie donnée. Par exemple, DZ disparaît selon 3 voies définies par les constantes k01, k21 et k31 et totalisant 100% du métabolisme de DZ correspondant à K1 ; ainsi, la voie DZ - > métabolites non identifiés par k01 vaut 15,84 % (=100 k01 / K1). Le tableau V-6 montre quelques pourcentages de DZ métabolisé en fonction de la voie de transformation chimique. | |||||||||||||||||||||
Tableau V-6 :
Contribution de chaque voie de transformation chimique au métabolisme de DZ par les
hépatocytes de singe entre 3 et 6 heures de culture.
|
|||||||||||||||||||||
| Seddon et coll. ont
analysé les cinétiques du DZ avec des cultures plus âgées (1, 2 , 4 et 6 jours).
Après 2 jours de culture les hépatocytes de singe perdent progressivement leur activité
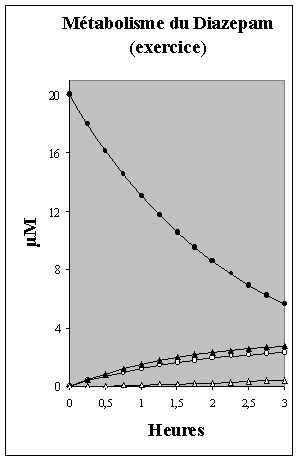
enzymatique de déméthylation sans altération significative de l'hydroxylation. A titre d'exercice, voici quelques données adaptées des résultats de Seddon et al. obtenus avec des hépatocytes cultivés au-delà de 48 heures. L'évolution des concentrations de DZ et de ses métabolites est représentée ci-dessous (Fig. V-12). Pour q1(0) = 40 nanomoles de DZ, nous avons les équations de s concentrations correspondant à chaque courbe : |
|||||||||||||||||||||
| c1 (µM)
= 20 e– 0,425 t c2 (µM) = – 8,108 (e– 0,425 t – e– 0,055 t) c3 (µM) = – 11,343 (e– 0,425 t – e– 0,45 t) c4 (µM) = 2,768 e–0,425 t + 9,91 e–0,055 t + 45,373 e–0,09 t – 58,051 e–0,1 t . |
V-37 | ||||||||||||||||||||
Figure V-12 : Evolution in vitro des concentrations en diazepam (DZ)et de ses métabolites dans le milieu de culture (2 ml) après introduction de 40 nanomoles de DZ dans des cultures vieillissantes d'hépatocytes de singe. Symboles : cercles pleins = DZ; cercles vides = NOR; triangles pleins = TEM; triangles vides = oxazepam (OX). |
|
||||||||||||||||||||
| Calculer toutes les microconstantes du système et la participation de chaque voie au métabolisme du DZ. Les tableaux V-7 et 8 rassemblent les résultats à obtenir. | |||||||||||||||||||||
| Tableau V-7 : Microconstantes du métabolisme du diazepam et de ses métabolites au contact d'hépatocytes de singe en culture (exercice). |
|
||||||||||||||||||||
Tableau V-8
: Contribution de chaque voie de transformation chimique au métabolisme de DZ par les
hépatocytes de singe entre 3 et 6 heures de culture.
|
|||||||||||||||||||||
| Il apparaît que les
voies de déméthylation le cèdent aux voies d'hydroxylation dont les constantes k21
et k42 sont préservées (Tab. V-5). Les voies d'élimination vers des produits
indéterminés sont largement prédominantes (100 – 30,2 = 69,2 % contre 29,95 % avec
les cultures de 3 h). Ces analyses in vitro de pure pharmacologie montre bien que l'analyse compartimentale peut s'appliquer à des systèmes autres que des organismes vivants entiers. L'un des avantages de la culture cellulaire est d'avoir accès à pratiquement tous les compartiments du système pour y effectuer les mesures de concentration. Parce que le procédé autorise la multiplication des expériences sans crainte de porter préjudice à un organisme humain ou animal il a été préconisé comme méthode de substitution à l'expérimentation animale. Malheureusement, celle-ci reste nécessaire dans la mesure où l'environnement vivant in situ est rarement réductible à l'environnement artificiel utilisé in vitro. |
|||||||||||||||||||||